常见的晶体结构
晶体结构是中学化学中的一个难点,如果对常见的晶体结构有所了解,则对我们的学习会有很大的帮助。下面是一些常见的晶体的晶胞,以a为晶胞参数,NA为阿伏加德罗常数。
1、常见共价晶体
金刚石:
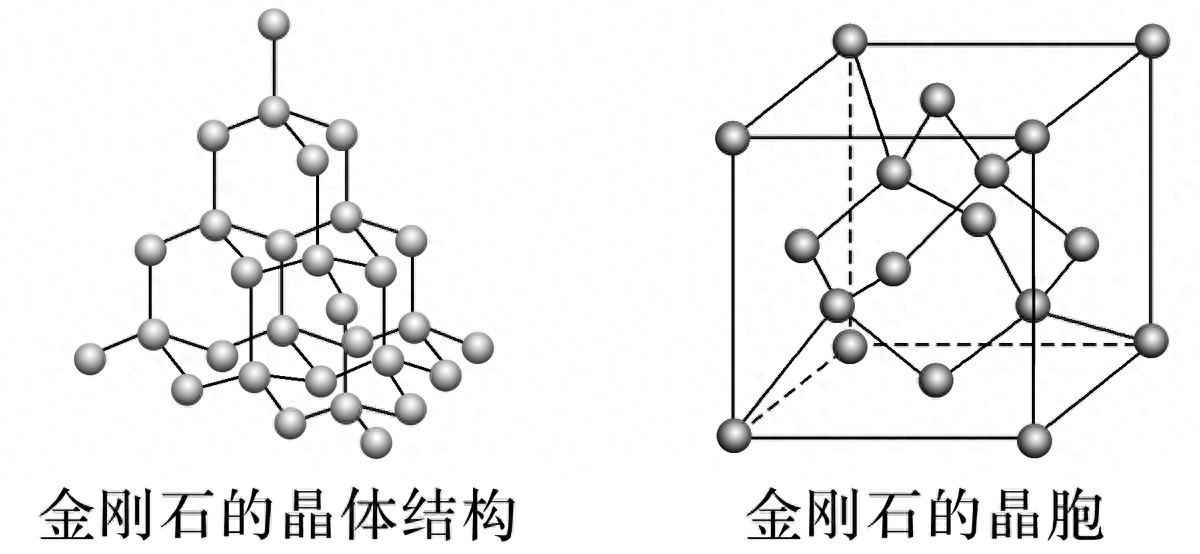
每个C与相邻4个C以共价键结合,键角均为109°28′,形成正四面体,配位数为4,C原子数与C—C数之比为1∶2。
8个C在顶点,6个C在面心,4个C在体心,每个晶胞中含8个C原子。如果将晶胞分成8个小立方体,其中相间的4个体心有一个C,另外4个为空。体心的C在体对角线上,两个最近的C之间的距离为体对角线的1/4。
最小碳环由6个C组成,6个C不在同一平面内,每个C原子被12个六元环共用。
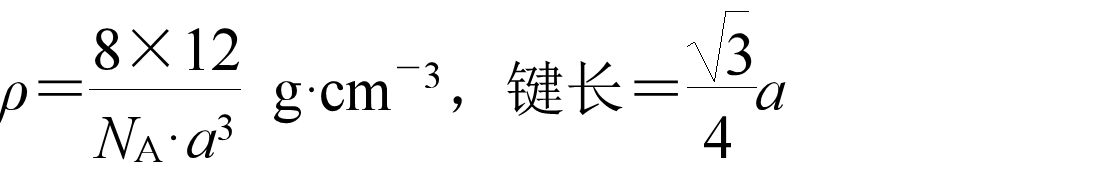

二氧化硅:

每个Si与4个O以共价键结合,形成正四面体结构。每个正四面体占有1个Si,4个O,每个O为两个四面体共用,Si与O的个数比为1∶2。
最小环上有12个原子,即6个O,6个Si。

碳化硅:
还有一些共价晶体结构与之类似。
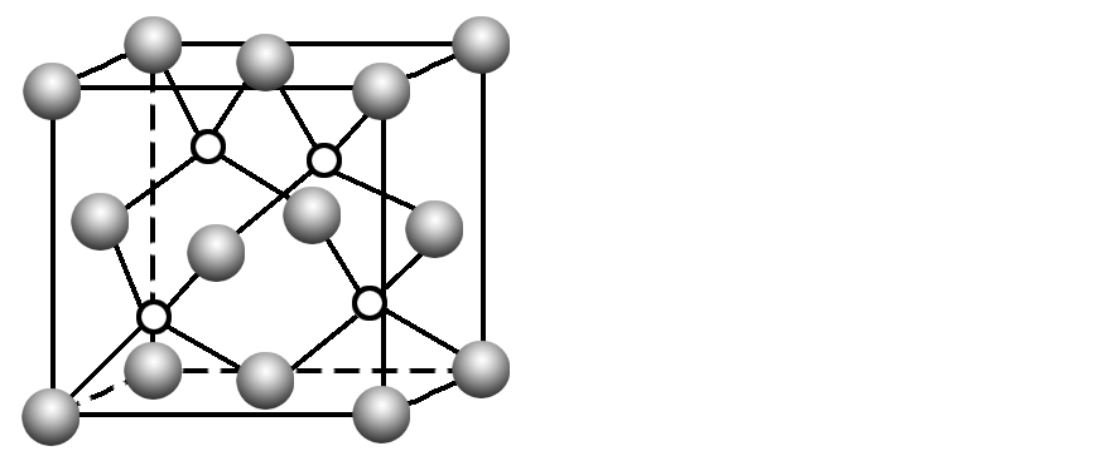
可以看作是将金刚石晶胞中的4个C替换成Si,每个C与另外4个Si或者每个Si与另外4个C形成正四面体结构。每个晶胞中有4个C和4个Si。
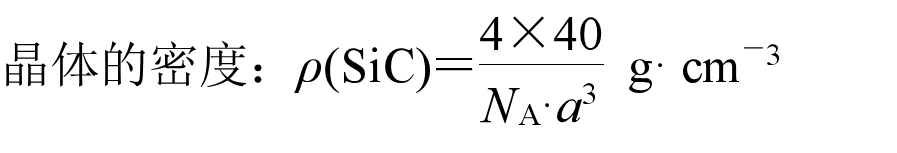

2、分子晶体
干冰、C60:
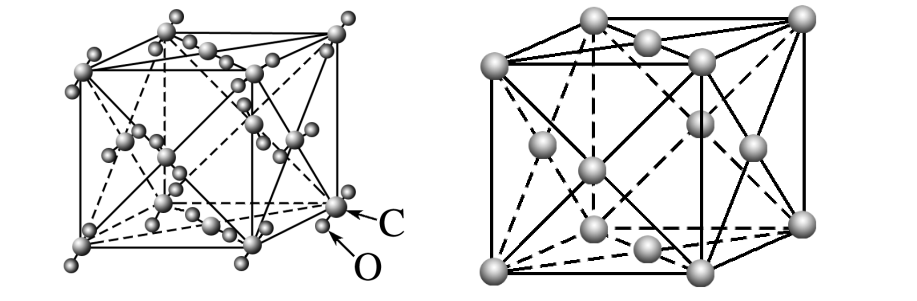
它们均采用分子密堆积,8个分子在立方体的顶角,在6个面的面心各有1个分子。每个分子周围紧邻的分子有12个,配位数为12,空间利用率高。紧邻的分子间的距离为面对角线长度的1/2。
它们的密度分别为:
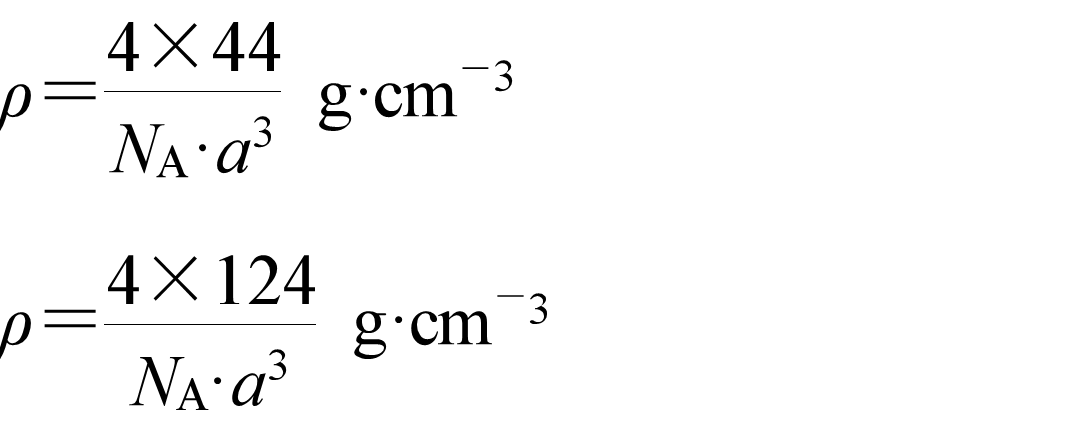

冰:
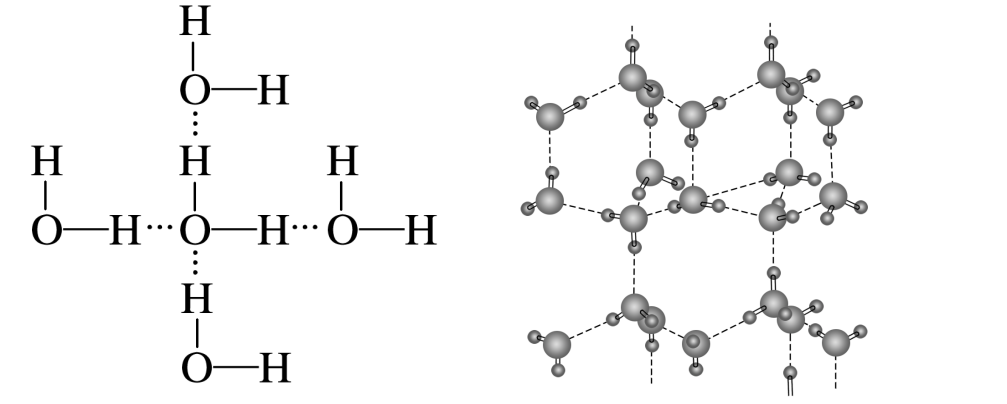
每个水分子通过氢键与另4个水分子形成一个正四面体(注意上图中画的是平面结构),每个氢键为两个水分子共有,一个水分子对应两个氢键。其配位数为4,分子间的空隙较大,空间利用率低,所以冰的密度偏小。
其晶胞结构类似金刚石的晶胞。

3、离子晶体
氯化钠:
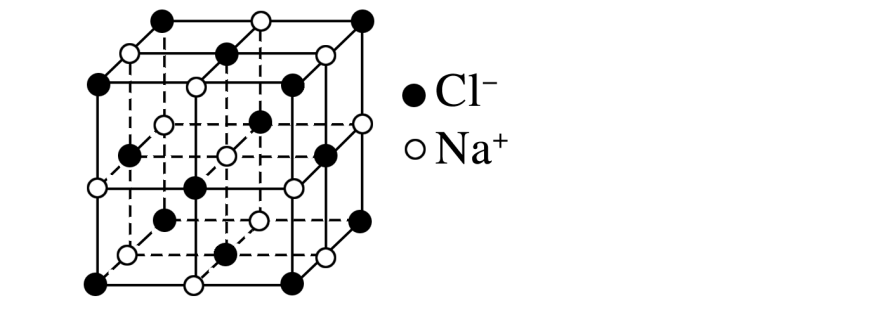
每个周围紧邻的有6个,每个周围紧邻的有6个,配位数均为6,这6个离子均围成一个正八面体。每个晶胞含4个和4个。
在每个周围最近且等距离的有12个,在每个周围最近且等距离的有12个。其距离是面对角线长度的1/2。
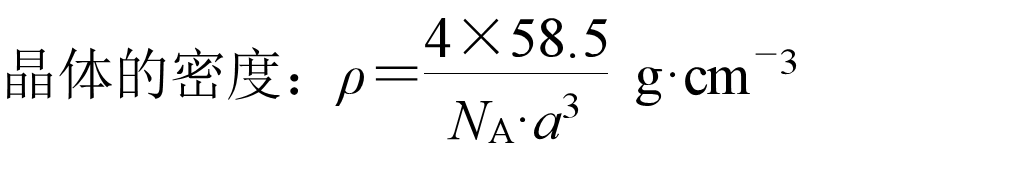

氯化铯:
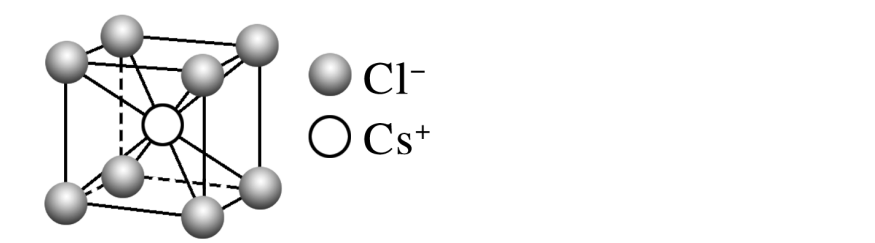
每个周围紧邻的有8个,每个周围紧邻的有8个,其距离为晶胞体对角线的1/2。配位数为8。每个晶胞含1个和1个。
在每个周围最近且等距离的有6个,在每个周围最近且等距离的有6个。
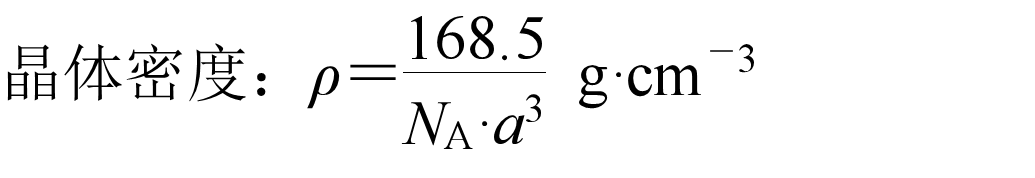

氟化钙:
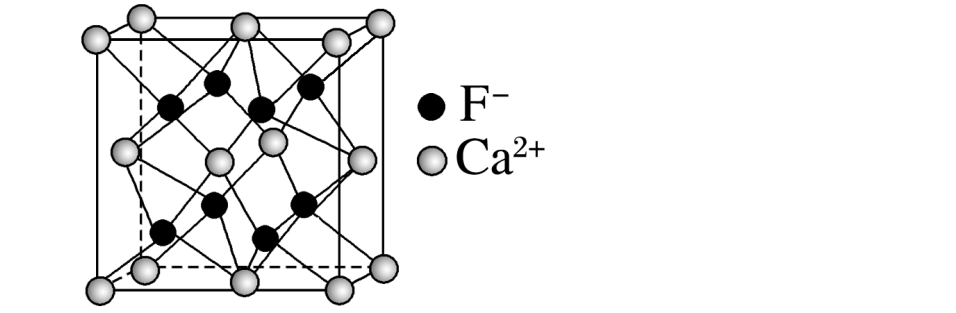
8个钙离子在顶点,6个钙离子在面心,氟离子在体心。的配位数为8,的配位数为4,每个晶胞含4个、8个。
与紧邻的4个构成一个正四面体。与之间最短的距离为体对角线长度的1/4。
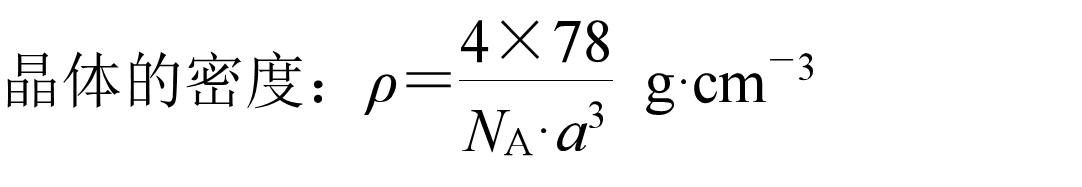

在分析过程中,可将遇到的晶体结构与上面这些常见的晶体结构进行对照,这样分析的难度就会大大降低。

